

La più ordinaria delle sostanze che presenta caratteristiche straordinarie: l'acqua!
Le sue particolari proprietà chimico-fisiche motivano una serie fenomeni anomali, di riscontro quotidiano, come l’ebollizione ad alta temperatura, l’elevato calore specifico, la capillarità, un elevato potere solvente e una notevole tensione superficiale. Ma prima di evidenziare le straordinarie caratteristiche dell’acqua rispetto alle altre sostanze, cerchiamo di capirne la causa, che risiede nella sua struttura molecolare.
La molecola dell’acqua
Tutti sappiamo che la molecola dell’acqua è costituita da un atomo di ossigeno e due di idrogeno, nulla di straordinario a parte la forma a V, con il più grande atomo di ossigeno al vertice e i due piccoli atomi di idrogeno alle estremità opposte, separati tra loro da un angolo di 104,45°.
All’interno della molecola gli atomi sono tenuti assieme dal legame covalente, che prevede la messa in comune degli elettroni presenti negli orbitali periferici. All’esterno la molecola d’acqua si presenta come un dipolo, infatti benché sia elettricamente neutra la forma a V da origine a due polarità distanziate tra loro: la carica “+” tra i due atomi di idrogeno e la carica “-“ dall’ossigeno.
Queste due zone con carica opposta danno origine ad una configurazione dipolare, che genera attrazione tra le varie molecole d’acqua, un’interazione chiamata appunto “dipolo-dipolo”.

Il legame idrogeno
Ma c’è un’altra forza che attrae tra loro le molecole d’acqua, più intensa di quella dovuta all’interazione dei dipoli (ma minore del legame covalente altrimenti le molecole si dissocerebbero); si tratta del cosiddetto legame idrogeno (o ponte idrogeno), a cui vanno attribuite le eccezionali proprietà fisiche dell’acqua.
Questo legame è dovuto alla presenza nella molecola degli atomi di idrogeno, che tendono a legarsi con gli atomi di ossigeno delle altre molecole vicine, con un’intensità esaltata dall’elevata elettronegatività dell’ossigeno, cioè dalla sua capacità di attrarre gli elettroni dei legami covalenti in cui è coinvolto, nello specifico l’idrogeno, che risulta con una parziale carica positiva e disponibile così al legame intermolecolare. Il legame idrogeno genera un’attrazione tra le molecole d’acqua con un’intensità che non ha eguali negli altri liquidi. Le molecole d’acqua possono formare quattro legami idrogeno con le loro vicine, per creare una struttura tetraedrica le cui facce sono triangoli equilateri.
Questa configurazione si ripete in tutto il liquido fino a formare una sorta di reticolo tridimensionale mobile, elastico, con legami che si formano e si rompono di continuo, con una frequenza dell’ordine di 10-12 secondi.
L’acqua non è, quindi, un semplice insieme di molecole tra loro dissociate, bensì una struttura legata, che come tale si comporta anche a livello macroscopico.
La natura "anomala" dell’acqua
Fatta luce sulla particolare struttura molecolare, è possibile comprendere meglio la natura anomala e le straordinarie caratteristiche dell'acqua e di alcuni suoi comportamenti, così frequenti nella vita di tutti i giorni da sembrare normali.

La temperatura di ebollizione dell’acqua
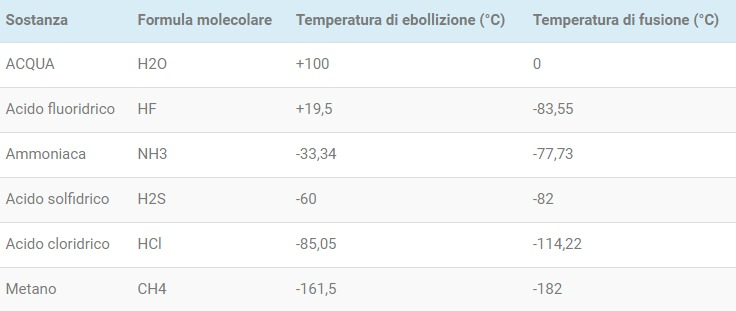
La temperatura di ebollizione (e quella di fusione) dell’acqua è molto più alta rispetto a quella di altre molecole simili, che si trovano infatti lo stato gassoso. L’acido solfidrico (H2S) è un gas, così come lo solo il metano (CH4), l’ammoniaca (NH3) e l’acido cloridrico (HCl), tutte molecole di dimensioni paragonabili a quella dell’acqua e con la presenza di atomi di idrogeno. A temperatura ambiente, quindi, l’acqua dovrebbe presentarsi allo stato gassoso e non liquido, tuttavia grazie ai forti legami idrogeno l’acqua presenta un punto di ebollizione enormemente più alto rispetto a quello delle sostanze molecolarmente simili. Per esempio l’acido solfidrico è una molecola con struttura affine a quella dell’acqua, ma lo zolfo è meno elettronegativo dell’ossigeno così i legami idrogeno che si generano sono debolissimi, quasi inesistenti.
Il fluoro invece è più elettronegativo dell’ossigeno ma la molecola di acido fluoridrico (HF) ha un solo idrogeno e può quindi creare un solo legame con le molecole circostanti (anziché i quattro dell’acqua), con un effetto macroscopico minore.
Di seguito una tabella con le temperature di ebollizione e fusione di alcune molecole simili all’acqua.
Capillarità dell’acqua
La capillarità è un fenomeno dovuto all’effetto combinato di forze di adesione e coesione grazie al quale l’acqua può risalire le pareti di uno stretto recipiente, violando il principio dei vasi comunicanti. Grazie alla capillarità l’acqua può raggiungere la cima anche degli alberi più alti e un fazzoletto di carta e una spugna si inzuppano con facilità. Con l’adesione le molecole dell’acqua stabiliscono un contatto con le molecole della parete del recipiente, grazie al legame idrogeno queste molecole riescono ad “arrampicarsi” lungo le pareti, mentre la forte coesione consente alla massa d’acqua di rimanere unita salendo. Questo fenomeno è tanto più evidente quanto più piccolo è il capillare.
Calore specifico dell’acqua
L’acqua ha un elevato calore specifico, questo significa che occorre molta energia per innalzarne la temperatura (4,184 J/g °C), una quantità superiore rispetto a quella richiesta da molte altre sostanze. Questa proprietà dipende ancora dai legami a idrogeno: l’agitazione termica delle molecole viene contrastata dalle forze di attrazione e una delle principali conseguenze di questo fatto è il volano termico, ovvero l’effetto calmierante sul clima dovuto alle grandi masse d’acqua.
Aumento del volume di congelamento dell’acqua
Un altro comportamento anomalo dell’acqua è dato dall’aumento del volume di congelamento della massa liquida. A livello domestico sono ben note le conseguenze di questo fenomeno. Quando la temperatura va sottozero le tubazioni piene d’acqua si rompono, così come una bottiglia piena messa nel freezer. Nell’acqua liquida agiscono due forze opposte, i legami a idrogeno da una parte tendono ad organizzare il reticolo di tetraedri mentre il movimento caotico delle molecole ne impedisce la perfetta formazione. Quando l’acqua congela i tetraedri sono obbligati a formarsi e la struttura complessiva assume la configurazione più aperta e meno densa. Questo è il motivo per cui, stranamente, il ghiaccio galleggia.
Il potere solvente dell’acqua
Un'altra delle straordinarie caratteristiche dell'acqua è il potere solvente di una sostanza è la capacità che la stessa ha di scioglierne un'altra, per formare una soluzione. L’acqua è un ottimo solvente, avendo la capacità di spezzare i legami che tengono unite molte sostanze. Pensiamo al cloruro di sodio, cioè il sale da cucina, che si scioglie rapidamente in acqua perché le molecole polari dell’acqua attraggono gli ioni di carica opposta sino a spezzare il legame ionico del cristallo. Un analogo fenomeno avviene nel processo di mineralizzazione, cioè quando l’acqua, passando attraverso le rocce, ne discioglie una parte arricchendosi di sali minerali
La tensione superficiale dell’acqua
La tensione superficiale è la densità superficiale di energia di legame sull'interfaccia tra un corpo continuo e un materiale di un'altra natura, un solido, un liquido o un gas. L’acqua ha un’elevata tensione superficiale perché tra le molecole è presente una forte coesione (dovuta ai legami idrogeno), che tende a tenerle unite.
Grazie a questo fenomeno molti insetti riescono a camminare sull’acqua, visto che la loro massa non è sufficiente a rompere i legami tra le molecole d’acqua presenti superficie, e non basta il principio di Archimede per spiegare il galleggiamento di una graffetta metallica o di una piccola monetina.
Ed è sempre grazie alla coesione, che genera una forte tensione superficiale, se le goccioline d’acqua assumono una forma sferica e se un bicchiere si può riempire per qualche millimetro oltre il bordo, senza traboccare.

Queste sono alcune delle più evidenti caratteristiche dell’acqua, un liquido straordinario, che usiamo dall’origine dei tempi ma che abbiamo iniziato a conoscere solo di recente.
A queste vanno aggiunte quelle che sono in fase di studio, come ad esempio quello secondo cui i suoni naturali, tra cui quello dell'acqua, rappresentano il sottofondo ideale per ottenere riposo, benessere psico-fisico, maggiore concentrazione e produttività.
Da oltre 80 anni, Culligan è leader globale nel trattamento dell’acqua, offrendo una gamma completa di soluzioni, dai semplici sistemi di filtrazione per la casa alle soluzioni per avere acqua da bere in aziende e ristoranti. In qualità di esperti di acqua globali e locali, ci impegniamo a trasformare l’acqua per avere un impatto sulla vita e proteggere il pianeta per tutti.

Continua a leggere


